definição de Transformações gasosas
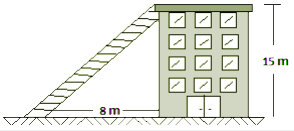
As transformações gasosas consistem em submeter uma massa fixa de um gás a diferentes condições enquanto uma grandeza é mantida constante. Os tipos são:
- Transformação isobárica: mudança com pressão constante;
- Transformação isotérmica: mudança com temperatura constante;
- Transformação isocórica, isométrica ou isovolumétrica: mudança com volume constante.
As grandezas físicas associadas aos gases (pressão, temperatura e volume) são denominadas variáveis de estado e uma transformação sofrida por um gás corresponde a variação de pelo menos duas destas grandezas.
O estudo dos gases foi difundido entre os séculos XVII e XIX por meio de cientistas que desenvolveram as leis dos gases. As leis foram obtidas através da manipulação das grandezas associadas e utilizando um modelo teórico chamado de gás perfeito, criado para estudar o comportamento de substâncias no estado gasoso.
Transformação isobárica
Na transformação isobárica a pressão da massa fixa de um gás é mantida constante, enquanto temperatura e volume variam.
A pressão é uma grandeza que relaciona a aplicação de uma força em determinada área, matematicamente expressa por:
Portanto, no estudo dos gases, a pressão de um gás corresponde à força exercida através dos choques das moléculas nas paredes internas do recipiente.
A transformação isobárica foi estudada, de forma independente, pelos cientistas Jacques Charles (1746-1823) e Louis Joseph Gay-Lussac (1778-1850). A partir de suas observações, foi formulada a Lei de Charles Gay-Lussac:
“Quando a pressão de uma massa fixa de gás é constante, seu volume é diretamente proporcional à sua temperatura absoluta.”
Por exemplo, mantendo a pressão de uma massa de gás constante, ao aumentar ou diminuir a temperatura da amostra, seu volume irá variar na mesma proporção.
Gráfico da transformação isobárica
A seguir, observe o gráfico da transformação isobárica.
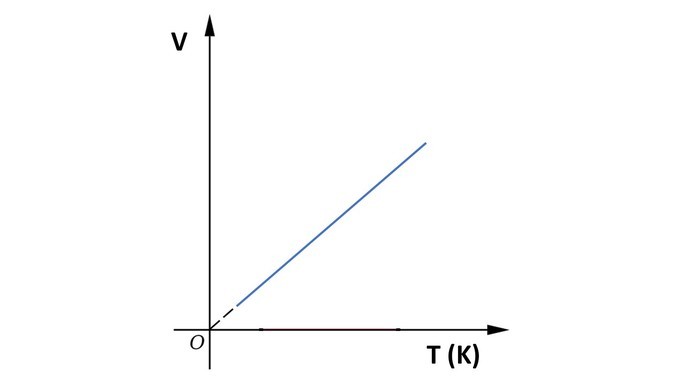
Transformação isotérmica
Na transformação isotérmica a temperatura da massa fixa de um gás é mantida constante, enquanto pressão e volume variam.
A temperatura é a grandeza que mede o grau de agitação das moléculas, ou seja, sua energia cinética.
Este tipo de transformação foi estudado por Robert Boyle (1627-1691), que formulou a lei:
“Quando a temperatura de um gás é constante, a pressão do gás é inversamente proporcional ao seu volume.”
Por exemplo, se reduzirmos o volume ocupado por um gás em um recipiente, a pressão exercida por suas moléculas dobrará.
Gráfico da transformação isotérmica
A seguir, observe o gráfico da transformação isotérmica.
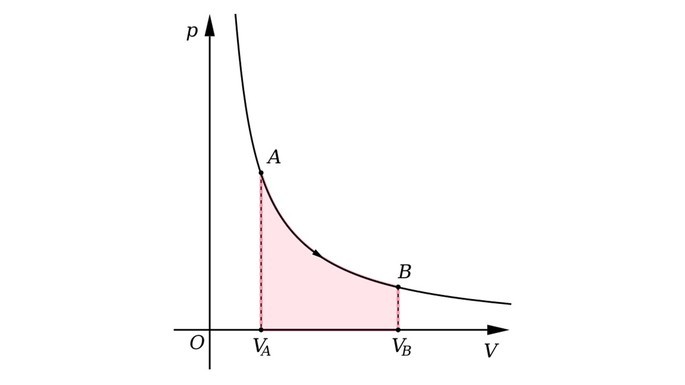
Transformação isovolumétrica
Na transformação isovolumétrica, isocórica ou isométrica, o volume de um gás é mantido constante, enquanto pressão e temperatura variam.
O volume de um gás corresponde ao volume do recipiente que ele ocupa, pois as moléculas preenchem todo o espaço disponível.
A transformação com o volume constante foi estudada por Jacques Charles (1746-1823), que postulou o que veio a ser conhecido como Lei de Charles:
“Quando o volume de um gás é mantido constante, sua pressão varia na mesma proporção que a temperatura da amostra.”
Por exemplo, ao dobrar a temperatura de determinado volume de gás, a pressão que o gás exerce nas paredes do recipiente também dobra.
Gráfico da transformação isovolumétrica
A seguir, observe o gráfico da transformação isovolumétrica.
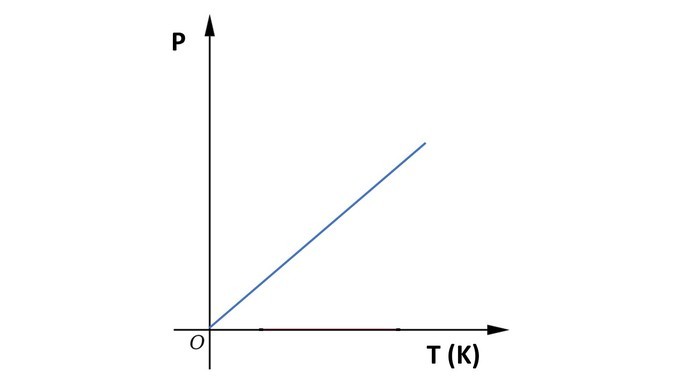
Fórmulas:
As fórmulas para calcular as transformações gasosas são:
Transformação isobárica:
Onde:
V = volume do gás
T = temperatura do gás (em K)
Transformação isotérmica:
Onde:
P = pressão do gás
V = volume do gás
Transformação isovolumétrica:
Onde:
P = pressão do gás
T = temperatura do gás (em K)
Lembre-se: quando estudamos transformações gasosas a temperatura deve estar sempre em Kelvin (K), nunca em Célsius (ºC)
Exemplos:
1 – Certa massa de gás encontra-se com pressão de 2atm e volume de 20 litros, qual será seu volume se mantivermos sua temperatura constante e aumentarmos a pressão para 5atm?
Resolução:
É uma transformação isotérmica então:
2- Certa massa de um gás encontra-se a uma pressão de 900N/M² com uma temperatura de 300K, Se mantivermos constante seu volume e aumentarmos sua temperatura para 400K qual será a pressão desse gás?
Essa é uma transformação isovolumétrica, nesse caso:
3 – Uma certa massa de gás encontra-se com volume de 0,5m³ à uma temperatura de 200K, se mantivermos a pressão constante e aumentarmos o volume para 1,375m³ , sua temperatura final será de?
Essa é uma transformação isobárica, portanto:
Comece a calcular:
Definição dilatação térmica
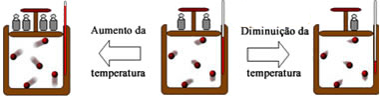
Dilatação Térmica é a variação que ocorre nas dimensões de um corpo quando submetido a uma variação de temperatura.
De uma maneira geral, os corpos, sejam eles sólidos, líquidos ou gasosos, aumentam suas dimensões quando aumentam sua temperatura.
Dilatação térmica dos sólidos
Um aumento de temperatura faz com que aumente a vibração e o distanciamento entre os átomos que constituem um corpo sólido. Em consequência disso, ocorre um aumento nas suas dimensões.
Dependendo da dilatação mais significativa em uma determinada dimensão (comprimento, largura e profundidade), a dilatação dos sólidos é classificada em: linear, superficial e volumétrica.
Dilatação linear
A dilatação linear leva em consideração a dilatação sofrida por um corpo apenas em uma das suas dimensões. É o que acontece, por exemplo, com um fio, em que o seu comprimento é mais relevante do que a sua espessura,
Para calcular a dilatação linear utilizamos a seguinte fórmula:
Onde,
ΔL: Variação do comprimento (m ou cm)
L: Comprimento inicial (m ou cm)
α: Coeficiente de dilatação linear (ºC-1)
Δθ: Variação de temperatura (ºC)
Dilatação superficial
A dilatação superficial leva em consideração a dilatação sofrida por uma determinada superfície. É o que acontece, por exemplo, com uma chapa de metal delgada.
Para calcular a dilatação superficial utilizamos a seguinte fórmula:
Onde,
ΔA: Variação da área (m2 ou cm2)
A: Área inicial (m2 ou cm2)
β: Coeficiente de dilatação superficial (ºC-1)
Δθ: Variação de temperatura (ºC)
Vale a pena destacar que o coeficiente de dilatação superficial (β) é igual a duas vezes o valor do coeficiente de dilatação linear (α), ou seja:
β = 2 . α
Dilatação volumétrica
A dilatação volumétrica resulta do aumento no volume de um corpo, o que acontece, por exemplo, com uma barra de ouro.
Para calcular a dilatação volumétrica utilizamos a seguinte fórmula:
ΔV = V0.γ.Δθ
Onde,
ΔV: Variação do volume (m3 ou cm3)
V: Volume inicial (m3 ou cm3)
γ: Coeficiente de dilatação volumétrica (ºC-1)
Δθ: Variação de temperatura (ºC)
Repare que o coeficiente de dilatação volumétrico (γ) é três vezes maior que coeficiente de dilatação linear (α), ou seja:
γ = 3 . α
Coeficientes de dilatação linear
A dilatação sofrida por um corpo depende do material que o compõe. Desta forma, no cálculo da dilatação é levado em consideração a substância de que o material é feito, através do coeficiente de dilatação linear (α).
Ex: coeficiente de dilatação da porcelana =
Ex: coeficiente de dilatação do chumbo =
Dilatação térmica dos líquidos
Os líquidos, salvo algumas exceções, aumentam de volume quando a sua temperatura aumenta, da mesma forma que os sólidos.
Entretanto, devemos lembrar que os líquidos não apresentam forma própria, adquirindo a forma do recipiente que os contém.
Por isso, para os líquidos, não faz sentido calcularmos, nem a dilatação linear, nem a superficial, só a volumétrica.
Ex: Coeficiente de dilatação da água =
Ex: Coeficiente de dilatação da acetona =