O teorema de Pitágoras relaciona as medidas dos lados de um triângulo retângulo da seguinte maneira:
Em um triângulo retângulo, a soma dos quadrados dos catetos é igual ao quadrado da hipotenusa.
O teorema de Pitágoras é muito importante para a Matemática, tendo influenciado outros grandes resultados matemáticos. Veja também uma das demonstrações do teorema e parte da biografia de seu criador.
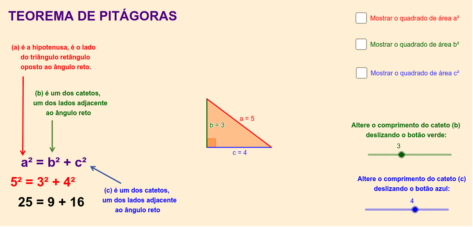
Fórmula
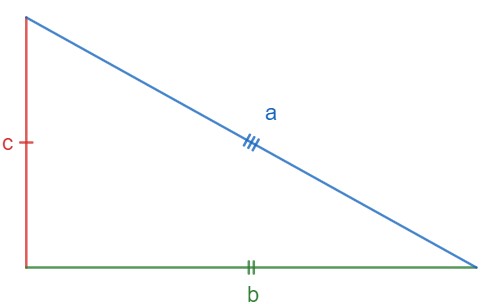
Para aplicação do teorema de Pitágoras, é necessário compreender as nomenclaturas dos lados de um triângulo retângulo. O maior lado do triângulo fica sempre oposto ao maior ângulo, que é o ângulo de 90°. Esse lado recebe o nome de hipotenusa e será representado aqui pela letra a.
Os demais lados do triângulo são chamados de catetos e serão aqui representados pelas letras b e c.
Teorema de Pitágoras e os números irracionais
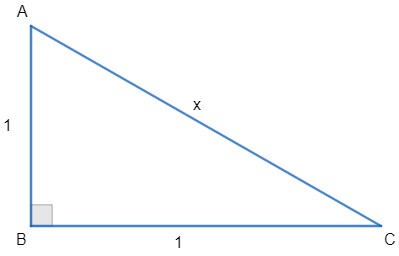
O teorema de Pitágoras trouxe consigo uma nova descoberta. Ao construir um triângulo retângulo em que os catetos são iguais a 1, os matemáticos, na época, depararam-se com um grande desafio, pois, ao encontrar o valor da hipotenusa, um número desconhecido apareceu. Veja:
Cálculo:
O número encontrado pelos matemáticos da época hoje é chamado de irracional.
Exemplo:
1 – Dois navios A e B partem em sentidos diferentes: o primeiro para o norte e o segundo para o leste, o navio A com velocidade constante de 30 Km/h e o navio B com velocidade constante de 40 Km/h. Qual será a distância entre eles após 6 horas?
Resolução:
Distância do navio A após 6 horas =
Distância do navio A após 6 horas =
Como um vai para o Norte e outro para o Leste esses são os nossos catetos, então a distância entre eles será a hipotenusa, ou seja:
Portanto essa será a distância dos dois navios após 6 horas
Um pintor está pintando um prédio de 15 metros, e sua escada está a 8 metros de distância do prédio formando um ângulo de 90º, qual é a altura da escada desse pintor?
Resolução:
Como a escada está formando um ângulo de 90º então a altura da escada é a hipotenusa e a distância e altura do prédio são os catetos, ou seja:
Portanto a altura dessa escada é de 17 metros.