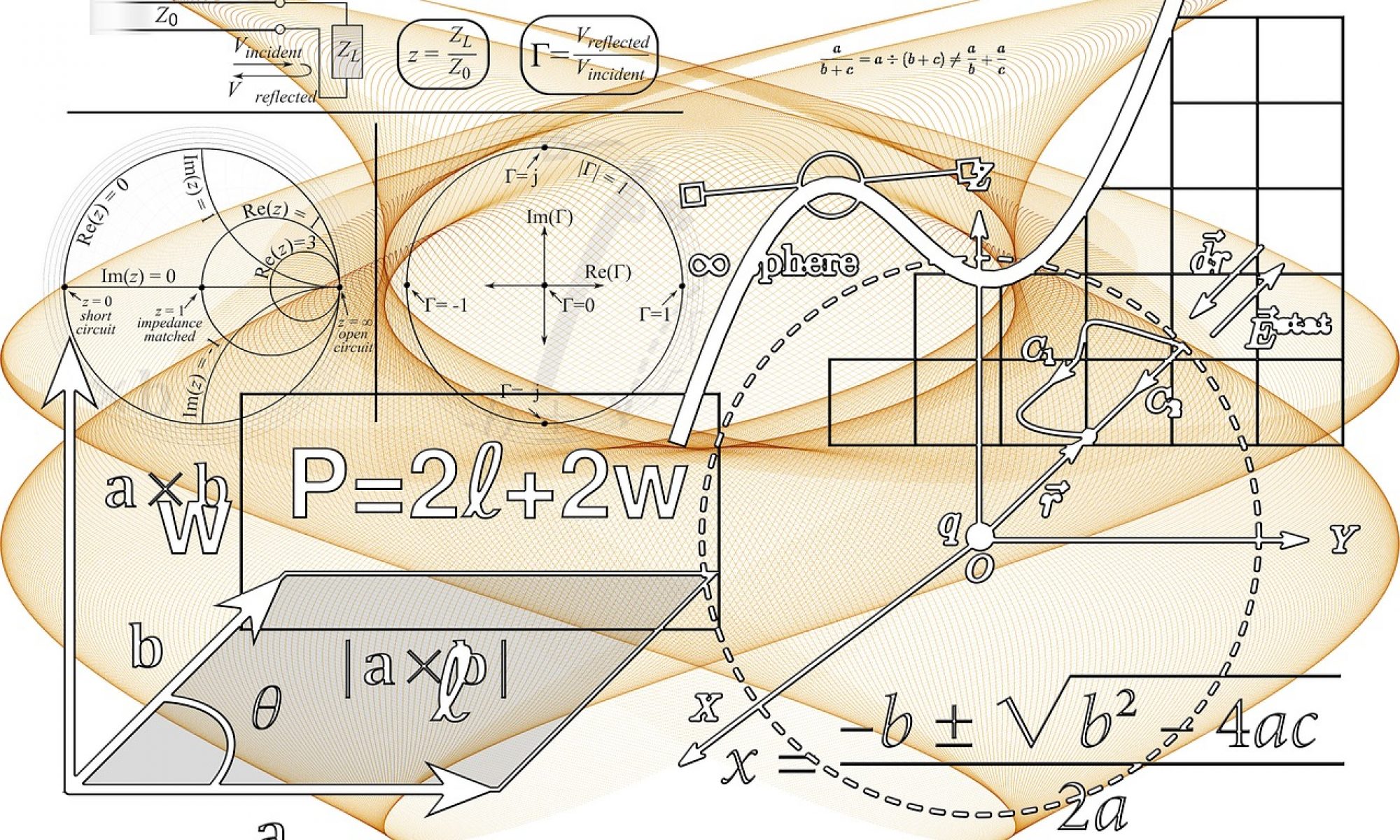
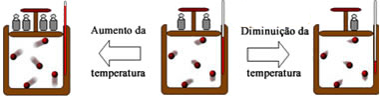
As transformações gasosas consistem em submeter uma massa fixa de um gás a diferentes condições enquanto uma grandeza é mantida constante. Os tipos são:
- Transformação isobárica: mudança com pressão constante;
- Transformação isotérmica: mudança com temperatura constante;
- Transformação isocórica, isométrica ou isovolumétrica: mudança com volume constante.
As grandezas físicas associadas aos gases (pressão, temperatura e volume) são denominadas variáveis de estado e uma transformação sofrida por um gás corresponde a variação de pelo menos duas destas grandezas.
O estudo dos gases foi difundido entre os séculos XVII e XIX por meio de cientistas que desenvolveram as leis dos gases. As leis foram obtidas através da manipulação das grandezas associadas e utilizando um modelo teórico chamado de gás perfeito, criado para estudar o comportamento de substâncias no estado gasoso.
Transformação isobárica
Na transformação isobárica a pressão da massa fixa de um gás é mantida constante, enquanto temperatura e volume variam.
A pressão é uma grandeza que relaciona a aplicação de uma força em determinada área, matematicamente expressa por:
Portanto, no estudo dos gases, a pressão de um gás corresponde à força exercida através dos choques das moléculas nas paredes internas do recipiente.
A transformação isobárica foi estudada, de forma independente, pelos cientistas Jacques Charles (1746-1823) e Louis Joseph Gay-Lussac (1778-1850). A partir de suas observações, foi formulada a Lei de Charles Gay-Lussac:
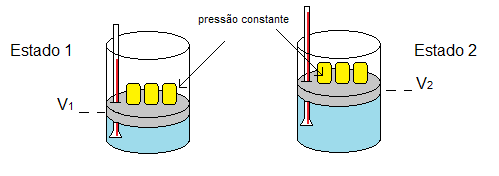
“Quando a pressão de uma massa fixa de gás é constante, seu volume é diretamente proporcional à sua temperatura absoluta.”
Por exemplo, mantendo a pressão de uma massa de gás constante, ao aumentar ou diminuir a temperatura da amostra, seu volume irá variar na mesma proporção.
Gráfico da transformação isobárica
A seguir, observe o gráfico da transformação isobárica.
Transformação isotérmica
Na transformação isotérmica a temperatura da massa fixa de um gás é mantida constante, enquanto pressão e volume variam.
A temperatura é a grandeza que mede o grau de agitação das moléculas, ou seja, sua energia cinética.
Este tipo de transformação foi estudado por Robert Boyle (1627-1691), que formulou a lei:
“Quando a temperatura de um gás é constante, a pressão do gás é inversamente proporcional ao seu volume.”
Por exemplo, se reduzirmos o volume ocupado por um gás em um recipiente, a pressão exercida por suas moléculas dobrará.
Gráfico da transformação isotérmica
A seguir, observe o gráfico da transformação isotérmica.
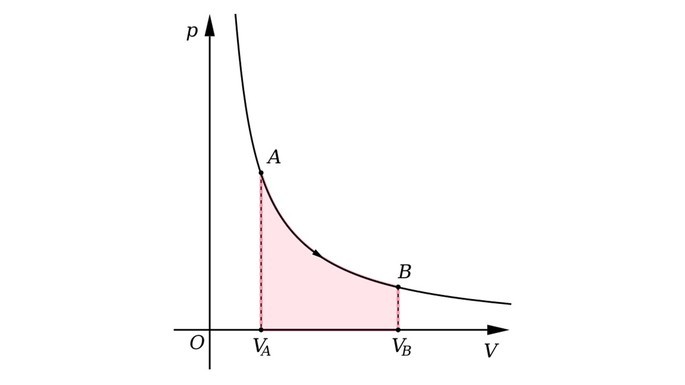
Transformação isovolumétrica
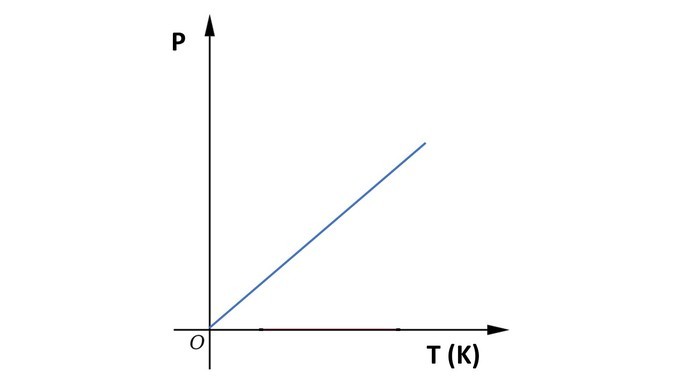
Na transformação isovolumétrica, isocórica ou isométrica, o volume de um gás é mantido constante, enquanto pressão e temperatura variam.
O volume de um gás corresponde ao volume do recipiente que ele ocupa, pois as moléculas preenchem todo o espaço disponível.
A transformação com o volume constante foi estudada por Jacques Charles (1746-1823), que postulou o que veio a ser conhecido como Lei de Charles:
“Quando o volume de um gás é mantido constante, sua pressão varia na mesma proporção que a temperatura da amostra.”
Por exemplo, ao dobrar a temperatura de determinado volume de gás, a pressão que o gás exerce nas paredes do recipiente também dobra.
Gráfico da transformação isovolumétrica
A seguir, observe o gráfico da transformação isovolumétrica.
Fórmulas:
As fórmulas para calcular as transformações gasosas são:
Transformação isobárica:
Onde:
V = volume do gás
T = temperatura do gás (em K)
Transformação isotérmica:
Onde:
P = pressão do gás
V = volume do gás
Transformação isovolumétrica:
Onde:
P = pressão do gás
T = temperatura do gás (em K)
Lembre-se: quando estudamos transformações gasosas a temperatura deve estar sempre em Kelvin (K), nunca em Célsius (ºC)
Exemplos:
1 – Certa massa de gás encontra-se com pressão de 2atm e volume de 20 litros, qual será seu volume se mantivermos sua temperatura constante e aumentarmos a pressão para 5atm?
Resolução:
É uma transformação isotérmica então:
2- Certa massa de um gás encontra-se a uma pressão de 900N/M² com uma temperatura de 300K, Se mantivermos constante seu volume e aumentarmos sua temperatura para 400K qual será a pressão desse gás?
Essa é uma transformação isovolumétrica, nesse caso:
3 – Uma certa massa de gás encontra-se com volume de 0,5m³ à uma temperatura de 200K, se mantivermos a pressão constante e aumentarmos o volume para 1,375m³ , sua temperatura final será de?
Essa é uma transformação isobárica, portanto: